การไทเทรตกรด-เบส (Acid-base
titration)
การไทเทรตกรด-เบส
หมายถึง กระบวนการหาปริมาณสาร โดยวิธีใช้สารละลายมาตรฐานที่ทราบค่าความเข้มข้นที่
แน่นอน
ให้ทำปฏิกิริยากับสารตัวอย่าง โดยอาศัยหลักการเกิดปฏิกิริยาระหว่างสารละลายกรดและเบสที่เข้าทำปฏิกิริยากันพอดี
ทำให้คำนวณหาความเข้มข้นหรือปริมาณของสารตัวอย่างดังกล่าวได้
วิธีการไทเทรตกรด-เบส
คือ นำสารละลายกรดหรือเบสตัวอย่างที่ต้องการวิเคราะห์หาปริมาณ
มาทำการไทเทรตกับสารละลายเบสหรือกรดมาตรฐานที่ทราบค่าความเข้มข้นที่แน่นอน
กล่าวคือ ถ้าสารละลายตัวอย่างเป็นสารละลายกรด ก็ต้องใช้สารละลายมาตรฐานเป็นเบส
นำมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ในการทำปฏิกิริยาพอดีกัน
จากนั้นนำไปคำนวณหาปริมาณของสารตัวอย่างต่อไป หรือทางตรงกันข้าม
ถ้าใช้สารละลายตัวอย่างเป็นเบส ก็ต้องใช้สารละลายมาตรฐานเป็นกรด
ตัวอย่างเช่น การหาค่าสารละลายกรด
HCl ว่ามีความเข้มข้นเท่าใดเราอาจใช้สารละลายมาตรฐาน NaOH
เข้มข้น 0.100 โมล/ลิตร มาทำการไทเทรตกับสารละลาย HCl ตัวอย่าง
จำนวนหนึ่ง (อาจจะเป็น 50 cm3 ) เมื่อทราบปริมาตรของ
NaOH ที่ใช้ในการทำปฏิกิริยาพอดีกับ HCl จำนวน 50 cm3
นี้โดยอินดิเคเตอร์เป็นตัวบอกจุดยุติ แล้วเราก็สามารถคำนวณหาความเข้มข้นของกรด
HCl ได้
สารละลายมาตรฐาน
ที่ทราบความเข้มข้นแน่นอน บรรจุอยู่ในเครื่องแก้วที่เรียกว่า
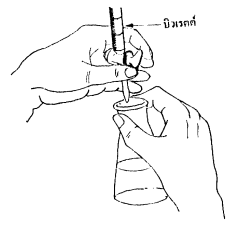
บิวเรตต์ ซึ่งจะมีก๊อกไขปิด-เปิดเพื่อหยดสารละลายมาตรฐานมายังขวดรูปกรวยที่บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์
ในการไทเทรต ค่อยๆ หยดสารละลายมาตรฐานลงมาทำปฏิกิริยากับสารตัวอย่างในขวดรูปกรวย
เขย่าหรือหมุนขวดรูปกรวยเพื่อให้สารผสมกันพอดี ไทเรตจนกระทั่งอินดิเคเตอร์เปลี่ยนสีก็หยุดไทเทรต
แล้วบันทึกปริมาตรสารละลายมาตรฐานที่ใช้ เพื่อนำไปคำนวณหา
pH สารละลายต่อไป
เครื่องแก้วเชิงปริมาตร ที่ใช้ในการถ่ายเทของเหลวตัวอย่าง
ลงในขวดรูปกรวยจะใช้เครื่องแก้วที่สามารถ อ่านปริมาตรได้ค่าที่ละเอียด
และมีค่าถูกต้องมากที่สุด นั่นคือจะใช้ ปิเปตต์ (จะไม่ใช้กระบอกตวงเพราะให้ค่าที่ไม่ละเอียด
และความถูกต้องน้อย) ซึ่งมีขนาดต่างๆ ให้เลือกใช้ เช่น ขนาด
1 cm3 , 5, 10, 25, 50 cm3 เป็นต้น
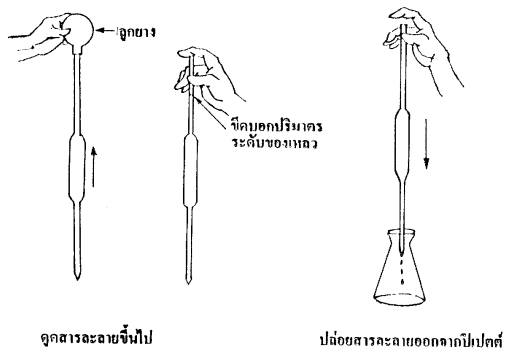
วิธีใช้ปิเปตต์จะใช้ลูกยางช่วยในการดูดสารละลาย โดยในตอนแรก
บีบอากาศออกจากลูกยาง ที่อยู่ปลายบนของปิเปตต์ แล้วจุ่มปลายปิเปตต์
ลงในสารละลายที่ต้องการปิเปตต์ แล้วค่อยๆ ปล่อยลูกยาง สารละลายจะถูกดูดขึ้นมาในปิเปตต์
เมื่อสารละลายอยู่เหนือขีดบอกปริมาตร ดึงลูกยางออก รีบใช้นิ้วชี้กดที่ปลายปิเปตต์ค่อยๆ
ปล่อยสารละลายออกจนถึงขีดบอกปริมาตรบน จากนั้นก็ปล่อยสารละลาย
ออกจากปิเปตต์สู่ขวดรูปกรวยจนหมด
การไทเทรตกรด-เบส
รูปแสดงการใช้ปิเปตต์
รูปแสดงการใช้บิวเรตต์
::กลับด้านบน:
อินดิเคเตอร์กับการไทเทรตกรด-เบส
อินดิเคเตอร์กรด-เบส
ที่เหมาะสมกับปฏิกิริยาการไทเทรตจะต้องมีค่า pH ที่จุดกึ่งกลางช่วงการเปลี่ยนสีใกล้เคียงหรือเท่ากับ
pH ที่จุดสมมูลของปฏิกิริยา นอกจากนี้ การเลือกใช้อินดิเคเตอร์กรด-เบส
ต้องพิจารณาสีที่ปรากฎ จะต้องมีความเข้มมากพอที่จะมองเห็นได้ง่าย
หรือเห็นการเปลี่ยนสีได้ชัดเจน ช่วงการเปลี่ยนสีของอินดิเคเตอร์
จะเกิดขึ้นในช่วง 2 หน่วย pH
ตัวอย่างเช่น การไทเทรตกรดแก่กับเบสแก่
pH ของสารละลายผลิตภัณฑ์ที่เกิดจากปฏิกิริยาการไทเทรต เมื่อถึงจุดสมมูลมีค่าใกล้เคียง
7 ก็ควรเลือกใช้อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนสีใกล้เคียงกับ
7 เช่น อาจใช้โบรโมไทมอลบลูหรือ ฟีนอล์ฟทาลีน ซึ่งจะเปลี่ยนจากไม่มีสีเป็นสีชมพู
ในช่วง pH 8.20-10.00 เป็นต้น ดังนั้น ถ้าทราบ pH ของสารละลายที่จุดสมมูลของปฏิกิริยาการไทเทรตก็สามารถเลือกอินดิเคเตอร์ที่เหมาะสมได้
การเลือกอินดิเคเตอร์ ก็ขึ้นอยู่กับชนิดของปฏิกิริยาระหว่างกรดกับเบส
เพราะที่จุดสมมูลของแต่ละปฏิกิริยานั้น มีค่า pH ที่ต่างกัน
การฟของการไทเทรตจะช่วยในการเลือกอินดิเคเตอร์ที่เหมาะสมได้ดี
เพราะกราฟจะแสดงค่า pH ของสารละลายขณะไทเทรต ตั้งแต่ก่อนจุดสมมูล
ที่จุดสมมูล และหลังจุดสมมูล จุดที่ pH ของสารละลายเปลี่ยนแปลงมาก
ซึ่งเป็นจุดสมมูลนั้น จะบอกช่วง pH ของอินดิเคเตอร์ที่จะเลือกใช้
ในการพิจารณาเลือกอินดิเคเตอร์ จากกราฟของการไทเทรต จะแบ่งออกตามชนิดของปฏิกิริยาดังนี้
1.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสแก่
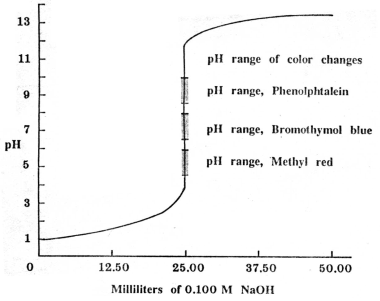
รูปกราฟของการไทเทรตระหว่างกรดแก่และเบสแก่
จะแสดง pH ที่จุดสมมูลอยู่ที่ pH ใกล้เคียง 7
จากกราฟ จะเห็นว่าค่า
pH เปลี่ยนแปลงรวดเร็วที่จุดใกล้ๆ จุดยุติ (ตั้งแต่ pH 4-10)
ดังนั้นอินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนแปลงสีระหว่าง
4 ถึง 10 ก็สามารถนำมาใช้ได้ ซึ่งอินดิเคเตอร์ที่เหมาะสมที่อาจใช้ได้
ได้แก่ เมทิลเรด (4.4-6.2) โบรโมไทมอลบลู (6.0-7.5) และฟีนอล์ฟทาลีน(8.2-10.0)
ดังแสดงในภาพ แต่เรามักจะนิยมใช้ฟีนอล์ฟทาลีน เพราะสังเกตการเปลี่ยนแปลงสีได้ชัดเจน
สำหรับ โบรโมคลีซอล กรีน (3.8-5.4) ไม่เหมาะสมที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแก่และเบสแก่
เพราะช่วงเปลี่ยนสีที่เป็นรูปเบสของอินดิเคเตอร์ จะเกิดก่อนจุดสมมูล
ทำให้เกิดความคลาดเคลื่อนในการบอกจุดยุติ
2.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
การเลือกอินดิเคเตอร์สำหรับการไทเทรตกรดอ่อน
เช่น กรดแอซิติก กับเบสแก่ เช่น NaOH จะมีข้อจำกัดมากกว่าที่จุดสมมูลของการไทเทรต
สารละลายจะมีโซเดียมแอซิเตต ทำให้สารละลายเป็นเบส มี pH มากกว่า
7
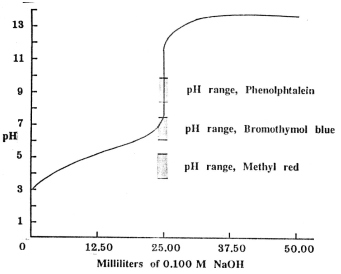
รูปกราฟแสดงการไทเทรตระหว่างกรดอ่อนกับเบสแก่และอินดิเคเตอร์ที่เหมาะสม
จากกราฟจะเห็นได้ว่า
เมทิลเรด จะเปลี่ยนสีก่อนจุดสมมูลจึงไม่เหมาะที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแอซิติกกับ
NaOH (เข้มข้น 0.100 M) ฟีนอล์ฟทาลีนเปลี่ยนสีที่ช่วงจุดสมมูลพอดี
โบรโมไทมอลบลู อาจจะใช้เป็นอินดิเคเตอร์ได้ดี เมื่อใช้สีมาตรฐานเทียบ
3.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
การเปลี่ยนแปลง
pH ของสารละลายขณะไทเทรตเบสอ่อน เช่น NH3 กับกรดแก่
เช่น HCl จะค่อยๆ ลดลง เมื่อใช้ HCl เป็นสารมาตรฐาน ที่จุดยุติจะได้เกลือ
NH4Cl และ pH < 7 ในการไทเทรต 0.100 M NH3
กับ 0.100 M HCl จะได้กราฟของการไทเทรต (ดังภาพ)
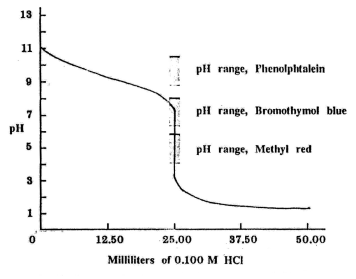
รูปกราฟของการไทเทรตระหว่าง 0.1000 M NH3 กับ
0.1000 M HCl
จากกราฟ เราสามารถพิจารณาชาวง
pH 3-7.5 ในการเลือกอินดิเคเตอร์ ซึ่งเราอาจใช้โบรโมไทมอลบลูหรือเมทิลเรดได้
แต่ไม่ควรใช้ฟีนอล์ฟทาลีนเพราะช่วง pH ของฟีนอล์ฟทาลีนมากกว่า
7 ทำให้เกิดความคลาดเคลื่อนในการบอกจุดสมมูล
ตัวอย่างที่ 1 กำหนดช่วง pH ของอินดิเคเตอร์ให้ดังนี้
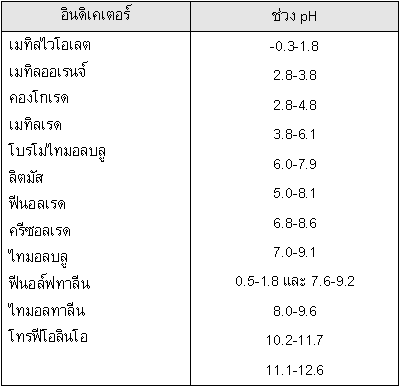
จงเลือกอินดิเคเตอร์ที่เหมาะสมที่สุดในการไทเทรตระหว่างสารละลาย
0.1 โมล/ลิตร HCN จำนวน 50 cm3 กับ 0.1 โมล/ลิตร
จำนวน 50 cm3 กำหนดค่า Ka ของกรด HCN
= 7.2 x 10-10 ที่ 25 0C และ log 8.4 = 0.92
วิธีทำ
HCN (aq) + NaOH(aq)  NaCN
(aq) + H2O (l) NaCN
(aq) + H2O (l)
| เพราะฉะนั้นจำนวนโมลของ HCN = |
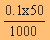 |
= 5 x 10-3 โมล |
| เพราะฉะนั้นจำนวนโมลของ NaOH = |
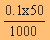 |
= 5 x 10-3 โมล |
| |
|
|
ดังนั้นสารละลายทั้งสองทำปฏิกิริยากันพอดีด้วยจำนวนโมลเท่ากันได้ผลิตภัณฑ์เป็น
NaCN = 5 x 10-3 โมล ในปริมาตร 50 + 50 = 100 cm3
| เพราะฉะนั้น [NaCN] = |
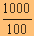 |
x 5 x 10-3 = 0.05 โมล/ลิตร |
NaCN แตกตัวได้ 100 % ดังนี้
NaCN (aq)  Na+ (aq) + CN- (aq) Na+ (aq) + CN- (aq)
0.05 0.05
0.05 โมล/ลิตร
CN-
(aq) + H2O  HCN
(aq) + OH- (aq) HCN
(aq) + OH- (aq)
ความเข้มข้นเริ่มต้น
0.05 0
0
ความเข้มข้นที่เปลี่ยนไป -x
+x
+x
ความเข้มข้นที่ภาวะสมดุล 0.05-x
x
x
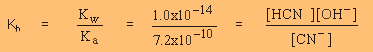
| 1.4 x 10-5 = |
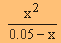 |
| 1.4 x 10-5 = |
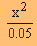 |
(  x มีค่าน้อยมาก 0.05-x x มีค่าน้อยมาก 0.05-x  0.05) 0.05) |
x
= 8.4 x 10-4 = [OH-]
pOH
= -log[OH-] = -log[8.4 x 10-4] = -0.92
+ 4 = 3.08
pH
= 14 - pOH = 14 - 3.08 = 10.92
เนื่องจาก pH ของสารละลายหลังไทเทรตเท่ากับ 10.92 ดังนั้นจะต้องเลือกใช้อินดิเคเตอร์ไทมอลทาลีน
ซึ่งมีช่วงการเปลี่ยนแปลง pH อยู่ระหว่าง 10.2-11.7 จึงจะเหมาะสมที่สุด
ตัวอย่างที่ 2 นำสารละลาย HA ซึ่งเป็นกรดอ่อนชนิดหนึ่งปริมาตร
50.00 cm3 ไปไทเทรตกับสารละลายมาตรฐาน NaOH เข้มข้น
0.15 โมล/ลิตร พบว่าเมื่อเติม NaOH ลงไป 12.00 cm3
จะทำให้สารละลายที่ได้มี pH 7 และเมื่อเติม NaOH ลงไป 16.00
cm3 จะถึงจุดยุติพอดี สารละลายกรด HA มีความเข้มข้นเริ่มต้นเท่าใด
และการไทเทรตกรด-เบสคู่นี้ควรใช้อินดิเคเตอร์ชนิดใด (กำหนด
Ka ของกรดอ่อน HA = 1.7 x 10-6) กำหนดให้
วิธีทำ
ที่จุดยุติจำนวนโมล
NaOH = 0.1500 x 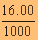 mol
mol
สมมติความเข้มข้นเริ่มต้นของ
HA = X โมล/ลิตร
HA
+ NaOH NaA
+ H2O NaA
+ H2O
จำนวนโมล
HA : NaOH = 1 : 1
เพราะฉะนั้นจำนวนโมล
HA = 0.1500 x 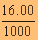 ด้วย
ด้วย
= X( 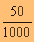 )
)
X(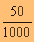 ) = 0.1500 x
) = 0.1500 x 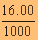
X = 0.048
ความเข้มข้นเริ่มต้น = 0.048 โมล/ลิตร
เพราะฉะนั้นความเข้มข้นของ NaA = 0.048 โมล/ลิตร
การไทเทรตกรดอ่อนกับเบสแก่ที่จุดยุติ มี NaA ซึ่งแตกตัวให้
A-
A- (aq) + H2O (l)  HA (aq) + OH-(aq)
HA (aq) + OH-(aq)
ความเข้มข้นเริ่มต้น
0.048 0
0
ความเข้มข้นที่เปลี่ยนไป -x
+x
+x
ความเข้มข้นที่ภาวะสมดุล 0.048-x
x x
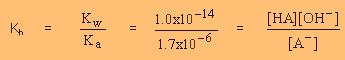
5.88
x 10-9 = 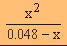
1.4
x 10-5 = 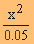 ( ( x มีค่าน้อยมาก 0.048-x
x มีค่าน้อยมาก 0.048-x  0.048)
0.048)
x
= 1.68 x 10-5 = [OH-]
pOH
= -log[OH-] = -log[1.68 x 10-5] =
4.77
pH = 14 - pOH = 14 - 4.77 = 9.22
ดังนั้น ควรใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์
|